Ob Corona-Impfstoffe zugelassen werden, hat mit der „epidemischen Lage von nationaler Tragweite“ nichts zu tun
Wegen der Corona-Pandemie hat die Bundesregierung im Juni die epidemische Lage von nationaler Tragweite verlängert. In Sozialen Netzwerken wird behauptet, Corona-Impfstoffe müssten andernfalls vom Markt genommen werden. Das stimmt nicht: Die Impfstoffe behalten ihre Zulassung, solange sie als sicher gelten.

Am 11. Juni hat der Bundestag die Verlängerung der epidemischen Lage von nationaler Tragweite beschlossen. Daraufhin ist auf Whatsapp, Telegram und Facebook mehrfach ein Bild aufgetaucht, das ein Foto der US-Serienfigur „Columbo“ zeigt. Darunter steht: „Warum die epidemische Lage nationaler Tragweite verlängert wurde? Weil ab dem Moment der Beendigung der Impfstoff die Notfallzulassung verliert und vom Markt genommen werden muss!“
Es handelt sich um eine Falschbehauptung: Die Zulassung der Impfstoffe gegen Covid-19 erfolgt auf EU-Ebene und hat nichts mit der epidemischen Lage von nationaler Tragweite in Deutschland zu tun.
Die Europäische Kommission hat eine sogenannte „bedingte Zulassung“ erteilt, bei der Impfstoffe strenge Sicherheitsstandards erfüllen müssen und fortlaufend überprüft werden. Treten Sicherheitsbedenken auf, kann die Zulassung gestoppt werden.
Zulassung von Impfstoffen hat nichts mit der epidemischen Lage von nationaler Tragweite zu tun
Die epidemische Lage von nationaler Tragweite gilt seit dem 25. März 2020 und wurde am 11. Juni 2021 zum vierten Mal verlängert. Sie ermöglicht der Bundesregierung unterschiedliche Maßnahmen zur Eindämmung der Coronavirus-Pandemie, darunter die Coronavirus-Impfverordnung. Die Impfverordnung regelt den Ablauf und die Organisation der Corona-Impfungen in Deutschland, aber nicht die Zulassung von Impfstoffen.
Die Feststellung der epidemischen Lage von nationaler Tragweite ist zudem Voraussetzung für die Maßnahmen, die Bundesländer auf Grundlage des Infektionsschutzgesetzes erlassen können. Darüber entscheidet jedes Bundesland selbst, so soll in Nordrhein-Westfalen die Lage laut Medienberichten ab dem 19. Juni nicht mehr verlängert werden.
Über die Zulassung eines Impfstoffs in Europa und damit auch in Deutschland entscheidet die Europäische Kommission, heißt es auf einer Internetseite des Bundesministeriums für Gesundheit. Erst nach EU-Zulassung könne ein Impfstoff in den Mitgliedstaaten verkauft werden.
Deutschland hält sich bei Coronavirus-Impfstoffen vor allem an Vorgaben der EU
Vier Hersteller haben bisher eine „bedingte Zulassung“ in der Europäischen Union für Covid-19-Impfstoffe erhalten: Astrazeneca, Biontech/Pfizer, Moderna und Johnson & Johnson wurde in klinischen Studien geprüft, sie gelten als sicher und wirksam. Eine „bedingte Zulassung“ ist keine „Notfallzulassung“.
Die EU-Kommission schreibt auf ihrer Webseite über den Unterschied: „Eine bedingte Marktzulassung erfolgt innerhalb eines kontrollierten und robusten Rahmens, der Schutzmaßnahmen bietet, den Notfallzulassungen möglicherweise nicht bieten“. Das Verfahren sei speziell so konzipiert, „dass Marktzulassungen so schnell wie möglich erteilt werden, sobald ausreichende Daten vorliegen“.
Für die Impfstoff-Zulassung in der EU ist die Europäische Kommission gemeinsam mit der Europäischen Arzneimittelagentur EMA zuständig. Eine bedingte Marktzulassung bedeutet, die EMA hat die bisher vorliegenden Studienergebnisse analysiert und ist zu dem Schluss gekommen, dass der Nutzen des Impfstoffs die Risiken nach aktuellem Wissensstand überwiegt.
Wird das EU-Zulassungsverfahren beschleunigt, müsse das im Interesse der Allgemeinheit geschehen
Eine bedingte Zulassung in der EU ist an Auflagen geknüpft und ermöglicht ein beschleunigtes Zulassungsverfahren – erteilt wird sie „im Interesse der Allgemeinheit“. Voraussetzungen dafür sind:
- Der Nutzen für die öffentliche Gesundheit durch die sofortige Verfügbarkeit des Arzneimittels auf dem Markt überwiegt die Risiken, die aufgrund der vorgesehenen Nachreichung weiterer Daten bestehen.
- Die Antragstellerin oder der Antragsteller legt umfassende Daten zu einem späteren Zeitpunkt vor.
- Ein ungedeckter medizinischer Bedarf wird erfüllt.
Entscheidend für eine solche Beschleunigung sind fortlaufende Überprüfungen, die es der EMA ermöglichen, Daten zu den Impfstoffen zu bewerten, sobald sie verfügbar werden, anstatt abzuwarten, bis alle Versuche abgeschlossen sind. An den Grundsätzen von Qualität, Sicherheit und Wirksamkeit ändert sich laut EMA jedoch nichts.
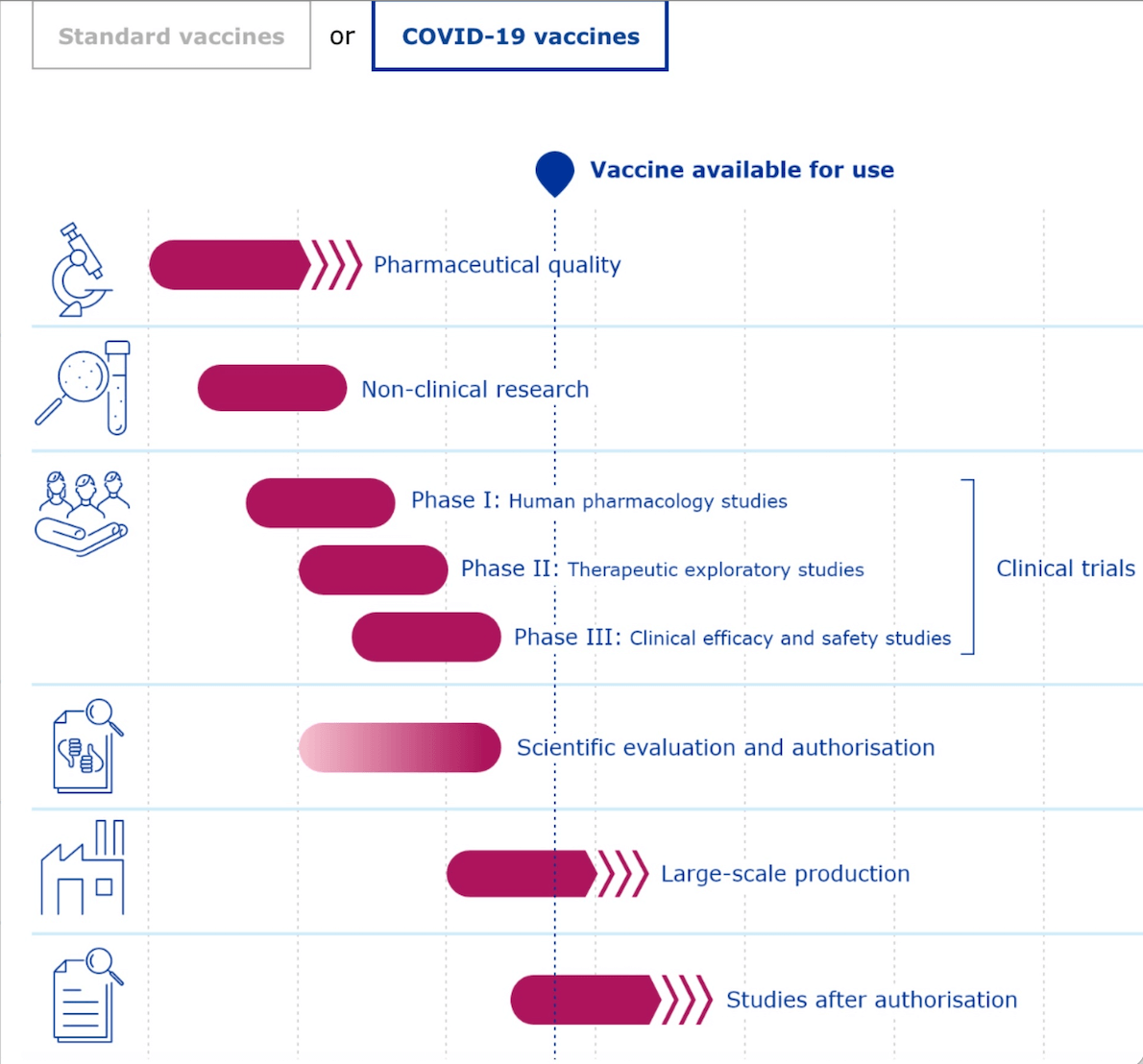
Die Impfstoffe haben folglich alle für die Zulassung notwendigen klinischen Studien abgeschlossen und danach eine bedingte Marktzulassung erhalten. Es werden weitere klinische Studien bis mindestens 2025 durchgeführt und mögliche Nebenwirkungen werden kontinuierlich und weltweit beobachtet.
Fazit: Corona-Impfstoffe können die Zulassung verlieren, wenn sie nicht sicher oder wirksam sind
Die Zulassung der Impfstoffe gegen Covid-19 hat mit der epidemischen Lage von nationaler Tragweite nichts zu tun. Empfehlungen über die Zulassung von Impfstoffen erteilt das Paul-Ehrlich-Institut (PEI) in Deutschland.
Das PEI sammelt und bewertet kontinuierlich Berichte zu Verdachtsfällen von unerwünschten Nebenwirkungen der Impfstoffe. Zudem prüft und genehmigt es die Produktionseinheiten (Chargen) der Corona-Impfstoffe anhand festgelegter Kriterien hinsichtlich Qualität, Wirksamkeit und Unbedenklichkeit.
Im März 2021 wurde der Impfstoff von Astrazeneca rund eine Woche ausgesetzt: Nach einigen schwerwiegenden Fällen von Hirnvenenthrombosen riet das PEI dazu, bis eine neue Bewertung der Europäischen Arzneimittelagentur EMA vorliege. Die EMA gab später Entwarnung, ein Warnhinweis auf das sehr geringe Risiko von thrombotischen Ereignissen wurde im Beipackzettel ergänzt.
Der Nutzen des Impfstoffs überwiegt die Risiken nach aktuellem Wissensstand, berichten sowohl das PEI als auch die EMA (Stand: 14. Juni).
Es stimmt also nicht, dass die Impfstoffe nach der Pandemie ihre Zulassung verlieren oder vom Markt genommen werden müssen: Sie werden eingesetzt, solange sie als wirksam und sicher gelten. Beides wird derzeit weltweit kontinuierlich überwacht.
Redigatur: Till Eckert, Steffen Kutzner
Die wichtigsten, öffentlichen Quellen für diesen Faktencheck:

