Krankenhaus
Im Krankenhaus sind resistente Keime besonders problematisch: Hier treffen sie auf geschwächte Patienten, die für Infektionen besonders anfällig sind. Hier kann es zudem zu großen Ausbrüchen kommen, wenn viele Kranke nah beieinander sind. Wer sind gute Ansprechpartner, um die Hygiene eines Krankenhauses einzuordnen, wo sind Informationen zu finden, was sind wichtige Studien? Hier bieten wir einen Überblick.
Daten und Organisationen
World Health Organization
Eine Behörde der Vereinten Nationen mit einem Fokus auf globale Gesundheitsversorgung.
Hat eine globale Übersicht über Antibiotikaresistenz veröffentlicht.
Veröffentlicht Empfehlungen zur Nutzung von Antibiotika und Hygiene.
European Centre for Disease Prevention and Control
Zentrale Europäische Behörde im Bereich Infektionskrankheiten.
Veröffentlicht jährlich einen Bericht zu Resistenzquoten ausgewählter Erreger in Europäischen Krankenhäusern.
Verbreitung von Krankenhausinfektionen. Mehr erfahren
Experten
Deutschland
Mathias Bonk
Think Global Health
Dr. med. Mathias Bernhard Bonk
Dangersen Dorf 24
21244 Buchholz
Matthias Bonk ist ein unabhängiger Berater zum Thema globale Gesundheit. Zurzeit arbeitet er für die WHO in Berlin und bei der Berliner Charite. Er ist zusammen mit dem wissenschaftlichen Magazin „The Lancet“ Organisator des Programms „New Voices in Global Health“. Bonk arbeitete im Bereich der Pädiatrie und Neonatologie in Deutschland, Großbritannien und Indien. Als unabhängiger Berater für globale Gesundheit ist es seine Aufgabe, politische Entscheidungsträger, Spezialisten und die Öffentlichkeit mithilfe von stichhaltigen und aktuellen Beweisen über Bedrohungen für die globale Gesundheit zu informieren. Er beschäftigt sich daher auch mit dem Problem von Antibiotika-Resistenzen.
Tim Eckmanns
Robert Koch-Institut
Nordufer 20
13353 Berlin
Telefon: 030 / 18754-3485
Tim Eckmanns ist Leiter des Fachgebiets "Nosokomiale Infektionen, Surveillance von Antibiotikaresistenz und –verbrauch" beim Robert-Koch Institut Berlin. Das Fachgebiet ist für Surveillanceaufgaben im Bereich Antibiotkaresistenz und -verbrauch und nosokomiale Ausbrüche, also Ausbrüche von Krankenhausinfektionen, zuständig. Bei solchen Ausbrüchen unterstützt Eckmanns die zuständigen Landesbehörden bei deren Untersuchung und Management. Eckmanns ist außerdem für das Zentrum zur Verhütung und Bekämpfung von Antibiotika-Resistenzen zuständig.
Petra Gastmeier, Krankenhaushygiene
Institut für Hygiene und Umweltmedizin
der Charité - Universitätsmedizin Berlin
Humboldt Universität Berlin
Campus Benjamin Franklin
Hindenburgdamm 27
12203 Berlin
Telefon: +49 30 450 577 612
Petra Gastmeier ist Leiterin des Instituts für Hygiene und Umweltmedizin der Berliner Charité. Und eine Koryphäe im Bereich Krankenhaushygiene. 2015 erhielt sie den Robert-Koch-Preis für Krankenhaushygiene und Infektionsprävention. Professor Gastmeier habe sich in besonderer Weise um die Bekämpfung von Krankenhausinfektionen und verbesserte Krankenhaushygiene verdient gemacht, heißt es in der Begründung. Sie baute das Krankenhaus Surveillance System KISS auf, das Krankenhäuser zu besserer Hygiene anhalten soll. Mit der Kampagne “Aktion Saubere Hände” führt sie ihren Kampf gegen Keime in Krankenhäusern weiter. Außerdem leitet sie das Referenzzentrum für die Überwachung von Krankenhausinfektionen.
Christoph Lübbert, Krankenhauskeime
Universitätsklinikum Leipzig AöR
Department für Innere Medizin, Neurologie und Dermatologie
Klinik für Gastroenterologie und Rheumatologie
Fachbereich Infektions- und Tropenmedizin
Liebigstraße 20
04103 Leipzig
Telefon: 0341 / 97-24970 oder 12222
Christoph Lübbert leitet den Fachbereich Infektions- und Tropenmedizin am Universitätsklinikum Leipzig. Am Tropeninstitut Liverpool machte er einen Abschluss im Bereich „Tropical Medicine and Public Health“. Als Spezialist für Infektionskrankheiten beschäftigt er sich auch mit multiresistenten Erregern. 2016 veröffentlichte er eine Studie zu Carbapenem-Resistenten Enterobakterien, die vor allem aus Ländern in Südeuropa wie Italien und Griechenland eingeschleppt werden.
Schweden
Otto Cars, Krankenhauskeime
Department of Medical Science, Infectious Diseases and Antiobiotics Research
Uppsala University
Akademiska sjukhuset
751 85 Uppsala
Telefon: +46 70 8920203
Otto Cars ist Professor am Institut für Medizin, Infektiöse Krankheiten und Antibiotika-Forschung an der Universität von Uppsala. Seit mehr als zwanzig Jahren macht er auf das Problem von Antibiotika-Resistenzen aufmerksam. Cars ist außerdem Gründer des internationalen Netzwerks ReAct, das kürzlich eine Anleitung zu verantwortlichem Gebrauch von Antibiotika veröffentlichte. 2015 erhielt er die Schwedische Königsmedaille für seinen ausdauernden Einsatz gegen die Bedrohung von Antibiotika-Resistenzen.
USA
John H. Rex, Presidential Advisory Council on Combating Antibiotic-Resistant Bacteria
Office of the Assistant Secretary for Health
Office of Communications
Department of Health and Human Services
Telefon: +1 (202) 205-0143
John Rex ist Mitglied des Presidential Advisory Council on Combating Antibiotic-Resistant Bacteria und Chefstratege bei dem internationalen Pharmakonzern AstraZeneca. Er arbeitete aber auch für zahlreiche kleine Pharmaunternehmen. Rex ist einer der beiden Mitgründer des New Drugs for Bad Bugs Programms, das darauf abzielt, Vertreter der Pharmaindustrie und Wissenschaftler zusammen zu bringen, um zu neuen Antibiotika zu forschen und sie zu entwickeln.
Studien
Schon in jungen Kindern gibt es resistente Erreger
Forscher um Ashley Bryce von der University of Bristol haben jetzt herausgefunden, dass bei Entzündungen der Harnwege einzelne Antibiotika bei Kindern teilweise nicht helfen. Das schreiben sie in einer Studie im Fachblatt „BMJ“.
Die Forscher gingen systematisch vor: Zunächst sichteten sie alle bisherigen Studien, die Antibiotika-Resistenz bei Harnwegsinfektionen zum Thema hatten – mit dem Erreger E. coli. Sie fanden 58 solche Untersuchungen aus 26 Ländern.
Als die Wissenschaftler die Daten auswerteten, kamen sie zu einem beunruhigenden Ergebnis. Innerhalb der OECD-Staaten, also in den wohlhabenden Ländern, gab es in jeder zweiten Probe eine Resistenz gegen das Antibiotikum Ampicillin. Bei Kindern trat die Resistenz häufiger auf, wenn sie zuvor mit einem Antibiotikum behandelt worden waren. Für Staaten außerhalb der OECD, etwa in Entwicklungsländern, lag die Quote gar bei 80 Prozent – was mit dem häufigeren Einsatz von Antibiotika in diesen Ländern erklärt werden könnte. Auch gegen andere Antibiotika gab es Resistenzen, wenn auch deutlich seltener.
Die Wissenschaftler folgern, dass Antibiotika-Resistenz schon bei der Behandlung von Kindern ernstgenommen werden muss – etwa indem man Kindern nicht per se das gleiche Antibiotikum verschreibt, sondern sie auf mögliche Resistenzen testet.
Ärzte lassen sich belehren, um weniger Antibiotika zu verschreiben
Die meisten Antibiotika werden von den Patienten zu Hause eingenommen, nicht im Krankenhaus. In Großbritannien liegt das Verhältnis bei rund 80 zu 20 – und auf einen großen Teil der daheim geschluckten Antibiotika könnte man wohl verzichten.
Wie kann man diesen Missbrauch beheben? Laut den Forschern um Michael Hallsworth vom Londoner „Behavioral Insights Team“ geht das erstaunlich einfach. Die Forscher suchten zunächst jene 20 Prozent der englischen Arztpraxen auf, in denen die meisten Antibiotika in ihrer Region verschrieben werden. Dafür griffen die Forscher auf öffentliche Datenbanken zurück.
Dann teilten sie die knapp 1600 Arztpraxen in zwei Gruppen ein. Jede zweite Arztpraxis bekam einen Brief, in dem die Ärzte darüber aufgeklärt wurden, dass sie besonders viele Antibiotika verschreiben. Das sei ein einfacher psychologischen Kniff, berichteten die Forscher – er rücke die betroffenen Ärzte in eine Außenseiterposition. Beigelegt war zudem ein Brief des englischen „Chief Medical Officer“.
Bereits diese einfache Maßnahme wirkte: Die Verschreibung der Antibiotika in diesen Praxen sank im Durchschnitt um drei Prozent im Vergleich zu der Kontrollgruppe von Ärzten, die keinen Brief bekommen hatten.
Drei Prozent, das klingt nicht nach viel. Doch auf die fast 800 Praxen gerechnet, waren das in einem halben Jahr bereits über 70.000 weniger Antibiotika-Verschreibungen, schätzen die Experten. Dadurch wären dem Gesundheitssystem fast 100.000 Pfund erspart worden – bei nicht mal 5000 Euro für Drucken und Verschicken der Prospekte. Dabei wissen die Forscher nicht einmal, wie viele der Ärzte den ursprünglichen Brief überhaupt aufgemacht und gelesen hatten.
Etwas anderes ist deutlich schwieriger, zeigte die Studie ebenfalls: Die Patienten über die Problematik von zu leichtfertig eingenommenen Antibiotika aufzuklären. Die Forscher teilten dazu die 1600 Praxen abermals in zwei Gruppen ein. Eine Hälfte bekam Poster und Prospekte zur Patientenaufklärung – doch nichts geschah, die Verschreibung von Antibiotika blieb gleich.
Die Schlussfolgerung der Forscher: Entweder sind die Patienten in dieser Studie unbelehrbar, oder aber bereits so saturiert mit Informationen über Antibiotika, dass eine Broschüre keinen Unterschied machen kann. Das ist keine gute Nachricht – da ein Großteil der weltweiten Bemühungen, den Antibiotikaverbrauch zu reduzieren, auf die Eigenverantwortung der Patienten zielt.
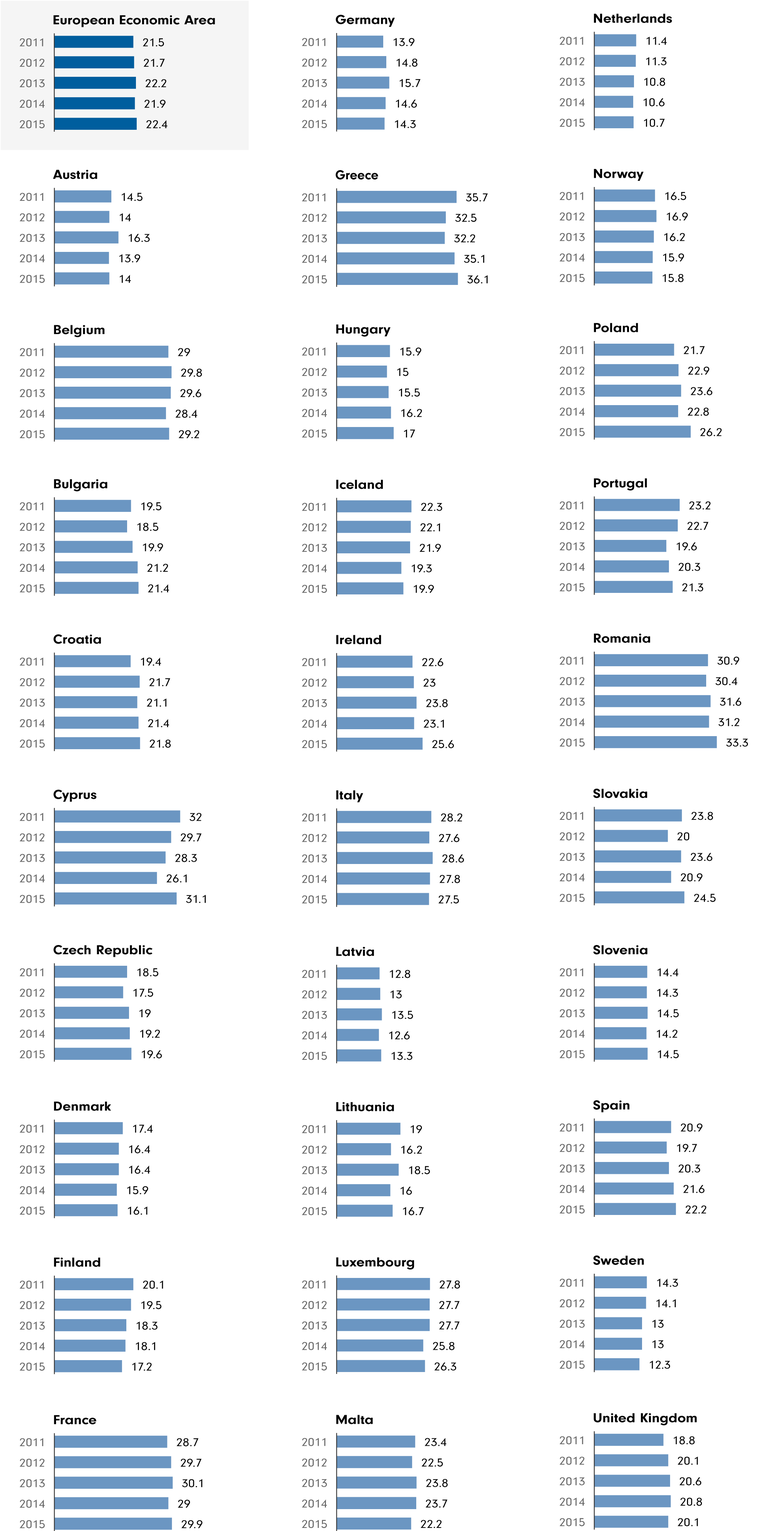
Antibiotikaverbrauch in der EU. Mehr erfahren
Ärzte sind hingegen offenbar einfacher zu beeinflussen. Die britischen Wissenschaftler rechnen aus, dass die Aufklärungskampagne den Antibiotikaverbrauch außerhalb von Krankenhäusern kurzfristig um fast ein Prozent senken könnte. Das wäre ein beträchtlicher Schritt in Richtung jener vier Prozent, um welche die britische Regierung den Antibiotika-Verbrauch im Land reduzieren will.
Ob sich dieser Weg auch für andere Länder lohnt, ist ungewiss: Die englischen Forscher profitierten davon, dass die Verschreibungsdaten einzelner Arztpraxen durch das nationale Gesundheitssystem zentral und öffentlich vorlagen. Das ist etwa in Deutschland nicht der Fall.
Resistenzen können bei Reisen eingeschleppt werden – bleiben aber meist nicht lange
Wer in exotische Länder reist, bringt oft resistente Darmkeime mit nach Hause. Dieses Phänomen haben Forscher um Etienne Ruppé von der Pariser Diderot-Universiät untersucht. Sie analysierten die Stuhlproben von über 800 Reisenden und veröffentlichten ihre Resultate im August 2015 im Fachblatt “Clinical Infectious Diseases”. Das Ergebnis: Einer von zwei Urlaubern war befallen von resistenten Keimen, für Asientouristen lag die Quote gar bei 70 Prozent. Die gute Nachricht: Die Keime hielten sich nicht lange im Darm der Heimkehrer – und das ohne Behandlung mit Antibiotika. Nach drei Monaten waren 95 Prozent der Befallenen den Keim wieder los.
Loh, H. et al. Precision spectroscopy of polarized molecules in an ion trap. Science 342, 1220–1222 (2013).
Schnelldiagnose für Resistenzen ein Schritt näher
Es gibt einen Widerspruch zwischen dem, was gut ist für einen Patienten. Und dem, was gut ist, um Antibiotika-Resistenzen im Zaun zu halten:
Ein Arzt will bei einer lebensgefährlichen Infektion schnellstmöglich ein Antibiotikum einsetzen, dass gegen so viele Keime wie möglich wirkt – denn er weiß nicht, mit welchem Keim er es zu tun hat. Normale Verfahren zur Identifikation des Keims können Tage dauern. Also schießt er mit der stärkst möglichen Waffe auf den Erreger – um den Patient in jedem Fall zu retten.
Doch damit steigt das Risiko, das eben diese stärkste Waffe bald wirkungslos wird – weil der Keim eine Resistenz auch gegen dieses Antibiotikum entwickelt. Ideal wäre es, wenn der Arzt seine Waffe höchst gezielt wählen könnte.
Das erscheint nun wahrscheinlicher: Wissenschaftler um Ritu Banerjee von der Mayo Clinick im amerikanischen Rochester haben ein Verfahren getestet, bei dem Keime und mögliche Resistenzen schon nach weniger als zwei Stunden identifiziert werden können. Sie testeten das Verfahren in der klinischen Praxis, dort schien es sich zu bewähren.
Resistenzen können manchmal schnell entstehen – und schnell verschwinden
Forscher um Jakob Haaber von der Stanford Universität haben einen Resistenzmechanismus entdeckt, der nur vorübergehend ist. Normalerweise entstehen Antibiotika-Resistenzen, weil Gene dauerhaft mutieren. Diese Veränderungen sind werden vererbt und können durch genetische Analyse im Labor entdeckt werden.
Etwas anderes beobachteten aber die Biologen um Haaber. Sie fanden, dass der Wundkeim Staphylococcus aureus, wenn er mit Colistin behandelt wird, auch eine Resistenz gegen ein anderes Antibiotikum namens Vancomycin entwickelt. Die Resistenz war aber nicht von Dauer. Sie bildete sich zurück, wenn Colistin entzogen wurde. Die Forscher folgern, dass dieser Mechanismus die Behandlung mit Antibiotika stören kann – ohne dass er mit einer herkömmlichen Analyse entdeckt werden kann.
Resistente Harnwegserreger sind weit verbreitet
Über Resistenzen außerhalb von Krankenhäusern ist wenig bekannt. Darum haben Forscher um Dean Ironmonger vom Field Epidemiology Service in Birmingham mit einem automatischen Web-Tool mehr als fünf Millionen Laborproben von Harnwegsinfektionen untersucht. Sie entdeckten, binnen eines Zeitraums von vier Jahren, eine kontinuierliche Zunahme von Resistenzen gegen das Antibiotikum Cephalosporin. Und zwar dann, wenn dieser Wirkstoff gegen die Keime Escherichia coli und Klebsiella pneumoniae eingesetzt wurde. Es ist die erste systematische Überprüfung von Antibiotika-Resistenzen in der breiten Bevölkerung Englands – und sie gibt Anlass zur Sorge.
Desinfektionsmittel können zu Resistenzen führen

Auch der Einsatz von Desinfektionsmittel kann zu Antibiotika-Resistenzen führen, haben Wissenschaftler um Mark Webber von der University of Birmingham nachgewiesen. Sie behandelten den Typhus-Keim Salmonella typhimurium mit verschiedenen Desinfektionsmitteln. Woraufhin sich Stämme bildeten, die gegen diese Desinfektionsmittel immun waren. Diese Stämme waren auch gegen Antibiotika resistent.
Ursache für die Doppelresistenz: Molekulare Pumpen, die für das Bakterium schädliche Stoffe unterschiedlicher Art aus der Zelle schleusen. Die Ergebnisse sollten zu einem vorsichtigeren Einsatz von Desinfektionsmitteln anregen, besonders zu Hause, wo sie kaum einen nachgewiesenen Nutzen haben.
Auch Schimmelpilze können resistent werden
Forscher um Oliver Bader von der Universität Göttingen haben resistente Schimmelpilze der Art Aspergillus fumigatus im Erdboden entdeckt. Der Pilz kann immungeschwächte Patienten befallen. Normalerweise wird er mit dem Stoff Azol behandelt, doch in den letzten Jahren breiten sich Resistenzen gegen diese Arznei aus. Wie oft sie vorkommen, ist nicht bekannt. Die Göttinger Forscher liefern mit ihrer Studie nun eine erste Schätzung: Bei etwa jedem zehnten Pilz, den sie im Boden fanden, war die Resistenz präsent.
Ein neues Antibiotikum namens Griselimycin
Eine gute Nachricht: Wissenschaftlern um Angela Kling aus Saarbrücken ist es gelungen, ein synthetisches Antibiotikum namens Griselimycin zu entwickeln, das möglicherweise gegen Tuberkulose eingesetzt werden kann. Bei Mäusen wirkte es bereits. Nun soll Griselimycin für eine Anwendung beim Menschen weiterentwickelt werden.
Hintergrund: Bislang wird das Antibiotikum Streptomycin gegen Tuberkulose verwendet. Doch mittlerweile gibt es Tuberkulose-Erreger, die resistent sind dagegen.
Streptomycin wurde aus einem Pilz namens Streptomyzes gewonnen. Dieser Pilz ist auch in der Lage, natürliches Griselimycin zu produzieren. Das ist seit langem bekannt. Doch dieses natürliche Griselymicin ist als Arzneimittel nicht geeignet, weil es im Körper schnell abgebaut wird. Doch mit den neuen synthetischen Veränderungen, könnte der Stoff Karriere in der Medizin machen.
Neue Ansätze der Antibiotikagewinnung
Viele Antibiotika wurden aus Bakterien isoliert, die im Erdboden leben. Diese Bakterien haben im Lauf der Evolution gelernt, sich gegen andere Mikroben durchzusetzen. Dazu nutzen sie Antibiotika, sie wirken auf andere Bakterien wie Gift. Für den Menschen sind sie meist harmlos und können deshalb eingesetzt werden, seine Krankheitserreger zu bekämpfen.
Doch mit der Zeit schien diese Quelle – der Erdboden, aus dem Antibiotika isoliert wurden – zu versiegen. Die Frage lag im Raum: Wurden schon alle Organismen entdeckt, die als Antibiotika-Produzent in Frage kommen?
Nein, haben im vergangenen Jahr Wissenschaftler um Losee Ling von NovoBiotic Pharmaceuticals im amerikanischen Cambridge. Bislang wurden neue Bakterien im Labor in Petrischalen gezüchtet. Was aber, wenn dort ein Großteil der Mikroorganismen gar nicht gedeihen kann?
Davon ausgehend, entnahmen die Forscher Bakterien-Proben aus dem Boden, füllten sie in Behältnisse und steckten diese wieder in den Boden zurück. In ihrer natürlichen Umgebnung konnten die Mikroben weiterwachsen. In einem der Behältnisse konnten die Forscher tatsächlich eine neue Substanz identifizieren: Das Antibiotikum Teixobactin, gegen das bislang keine Resistenz nachgewiesen wurde. Womöglich ist dies nur der erste Vertreter einer ganzen Reihe von Substanzen, die bislang nicht im Labor kultiviert werden konnten.
Kombinationspräparate von zwei Antibiotika können sich gegen Resistenzen bewähren
Helicobacter pylori ist ein gefährlicher Keim. Er befällt Magen und Darm, verursacht dort Geschwüre und manchmal sogar Krebs. Gegen gängige Antibiotika entwickelt er Resistenzen. Jetzt haben Wissenschaftlern um Jyh-Chin Yang von der taiwanesischen National Taipeh Universität den Keim erfolgreich mit einer Kombination aus zwei Wirkstoffen behandelt. Nicht nur wird die Infektion effizienter behandelt – es kann zudem auch die Entwicklung von Resistenzen umgangen werden.
Man weiß schon länger, dass Kombinationstherapien aus zwei oder mehreren Antibiotika womöglich langsamer zu Resistenzen führen – weil es Keimen schwer fällt, sich gleichzeitig gegen mehrere verschiedene Stoffe zur Wehr zu setzen. Doch bislang sind Kombinationen unbeliebt, weil sie komplizierter einzusetzen sind als ein einzelnes Präparat.
